INTRODUCTION
L’objectif de RhD Education est d’aider les gynécologues-obstétriciens, les sages-femmes, les médecins et les femmes à rester informés sur les problèmes d’incompatibilité RhD entre les parents, impactant le développement, le bien-être et la santé de leur futur enfant. Bien que l’incompatibilité Rh soit connue depuis près de cent ans et que la prophylaxie anti-Rh(D) a été introduite il y a plus de cinquante ans, ce problème affecte encore environ 50 % des grossesses dans le monde, entraînant une mortalité et une morbidité périnatales significatives et/ou des complications postnatales graves.
Les récentes lignes directrices promues par la FIGO (Fédération internationale de gynécologie et d’obstétrique) et l’ICM (Confédération internationale des sages-femmes) publiées à la fin de l’année 2021 soulignent l’importance de recentrer l’attention sur ce problème. Les stratégies incluent :
- Introduction du typage sanguin de routine chez les femmes en âge de procréer ou au début de la grossesse.
- Investissement dans l’administration gratuite d’immunoglobulines comme priorité de santé publique mondiale.
Ces objectifs sont également soutenus par le Consortium WIRhE (Worldwide Initiative for Rh disease Eradication), créé à l’Université de Columbia en 2018. Le Consortium a mis en place une Académie internationale de conseillers qui collaborent à ce site Web et contribuent à maintenir RhD Education à jour et pertinent. Ces conseillers servent d’ambassadeurs pour la mise en œuvre des stratégies recommandées dans de nombreuses régions du monde.
L’antigène Rhésus D joue un rôle crucial dans la prévention de la maladie hémolytique du fœtus et du nouveau-né (MHFN), aussi connue sous le nom d’érythroblastose fœtale. La sensibilisation au rhésus peut entraîner une anémie hémolytique chez le fœtus si elle n’est pas correctement prise en charge. L’identification précoce du gène RhD du fœtus et la mise en œuvre d’une prophylaxie anti-Rh(D) sont des stratégies essentielles pour prévenir ces complications.
RhD Education s’engage à fournir des informations précises et actuelles sur l’incompatibilité RhD et ses implications. En suivant les lignes directrices et les stratégies recommandées, nous pouvons réduire les risques associés et améliorer les résultats pour les mères et leurs enfants à travers le monde.
CE QU’IL FAUT SAVOIR SUR LA MHFN
Comment les anticorps de la mère attaquent-ils le fœtus dans la MHFN ?
La maladie hémolytique du fœtus et du nouveau-né (MHFN) est une affection causée par une attaque du système immunitaire maternel, sensibilisé par des anticorps spécifiques dirigés contre des antigènes de groupe sanguin présents à la surface des globules rouges (GR) du fœtus ou du nouveau-né, mais absents sur les GR maternels. La MHFN peut entraîner des conséquences pathologiques allant de l'anémie hémolytique légère à sévère du fœtus et de l'anasarque fœtale à l'hyperbilirubinémie néonatale sévère et à l'ictère nucléaire, des conditions avec des taux de morbidité et de mortalité significatifs.
- Quel est le lien entre la MHFN et le facteur Rh ?
- Épidémiologie
- Comment prévenir la maladie hémolytique Rh ?
- Les types de MHFN
- L’incompatibilité ABO
- L’allo-immunisation aux antigènes érythrocytaires du fœtus ou du nouveau-né
- Le système Rh
- Quel antigène est responsable des cas les plus graves de MHFN ?
- Quelle est la physiopathologie de la MHFN ?
Quel est le lien entre la MHFN et le facteur Rh ?
L’antigène le plus communément impliqué dans ce mécanisme d’allo-immunisation dû à l’incompatibilité antigénique est l’antigène Rhésus D (RhD). Néanmoins, un nombre de plus en plus important d’antigènes différents potentiellement impliqués dans la pathogenèse de ce trouble a été découvert depuis la première description de la maladie par le Dr Louis K. Diamond en 1932, lorsqu’il a évoqué l’érythroblastose fœtale chez le nouveau-né en se basant sur des frottis périphériques. Le groupe de travail de la Société internationale de transfusion sanguine (International Society of Blood Transfusion Working Party, ISBT WP) pour l’immunogénétique des globules rouges et la terminologie des groupes sanguins reconnaît actuellement 43 systèmes de groupes sanguins contenant 345 antigènes de globules rouges.
Épidémiologie
L’incompatibilité Rhésus a une distribution mondiale variant selon les zones géographiques, les races, les ethnies et les facteurs de risque. Le groupe sanguin Rh négatif est plus répandu chez les Blancs (15 %) que chez les Afro-Américains (5 à 8 %) ou les Asiatiques et Amérindiens (1 à 2 %). Ainsi, une femme blanche Rh négatif a 85 % de chances de concevoir avec un homme Rh positif. Cette incompatibilité fréquente augmente le risque de MHFN lors de toute hémorragie fœto-maternelle (HFM). Il suffit de 0,1 ml de sang fœtal entrant dans la circulation maternelle pour provoquer une allo-immunisation, entraînant une anémie hémolytique fœtale variable en gravité.
Comment prévenir la maladie hémolytique Rh ?
Grâce à la prévention, au dépistage précoce et à la prise en charge, l’incidence et la prévalence de la MHFN ont diminué de manière exponentielle au cours des 50 dernières années. L’immunoprophylaxie RhD, introduite en 1968, a réduit l’incidence de la MHFN RhD de 1 % à 0,1 %. L’administration d’immunoprophylaxie avant et après l’accouchement est efficace à près de 99 % pour prévenir la sensibilisation maternelle au RhD.
Les directives actuelles recommandent une immunoprophylaxie avec des IgG anti-RhD pour toutes les femmes RhD négatives, non sensibilisées, selon les calendriers suivants :
- À la 28e semaine de gestation pour chaque grossesse.
- Immédiatement après l’accouchement d’un nouveau-né RhD positif.
- Lors de tout événement susceptible d’exposer la mère à l’antigène RhD (avortement, fausse couche, traumatisme abdominal).
Cependant, près de 50 % des femmes dans le monde n’ont pas accès à cette immunoprophylaxie, en raison d’un manque de sensibilisation, de disponibilité et/ou d’accessibilité financière. Cet écart est particulièrement prononcé dans les pays à faible revenu, mais même dans les pays à revenu élevé, l’immunoprophylaxie reste inférieure au seuil optimal.
L’écart entre l’offre et la demande d’IgG anti-Rh(D) est le plus important dans les pays à faible revenu, tels que les super-régions d’Asie du Sud et subsaharienne, d’Asie de l’Est, du Sud-Est et du Pacifique, les pays d’Europe de l’Est et d’Asie centrale, les pays d’Amérique latine et des Caraïbes, et les pays d’Afrique du Nord et du Moyen-Orient ; cependant, dans les pays à revenu élevé, l’immunoprophylaxie pour la sensibilisation maternelle au Rh(D) est également inférieure au seuil optimal nécessaire pour assurer une prévention complète.
Des efforts supplémentaires sont nécessaires pour remédier à cette situation encore très répandue, à commencer par la sensibilisation à la maladie de Rh et aux moyens de la prévenir et de la traiter. Ce site web a cette mission spécifique.
Les types de MHFN
La maladie hémolytique du fœtus et du nouveau-né (MHFN), également connue sous le nom d’érythroblastose fœtale, est une maladie à médiation immunitaire dans laquelle les anticorps maternels attaquent les globules rouges (GR) fœtaux ou néonataux en raison d’incompatibilités antigéniques, ce qui entraîne une hémolyse dans la circulation sanguine fœtale ou néonatale. La MHFN peut être à l’origine de taux de morbidité et de mortalité importants, en particulier dans les environnements de soins de santé aux ressources limitées.
Les mécanismes par lesquels les anticorps maternels se développent et attaquent les antigènes des GR fœtaux ou néonataux sont principalement représentés par l’incompatibilité ABO et l’allo-immunisation due à la sensibilisation du Rh maternel aux antigènes de surface des GR fœtaux ou néonataux par la transfusion et l’hémorragie fœto-maternelle (HFM) pendant la grossesse ou lors de l’accouchement.
Les différents types de MHFN sont classés en fonction de l’alloantigène qui déclenche la réponse. Les types comprennent ABO, anti-RhD, anti-RhE, anti-Rhc, anti-Rhe, anti-RhC, les combinaisons multi-antigènes et anti-Kell.
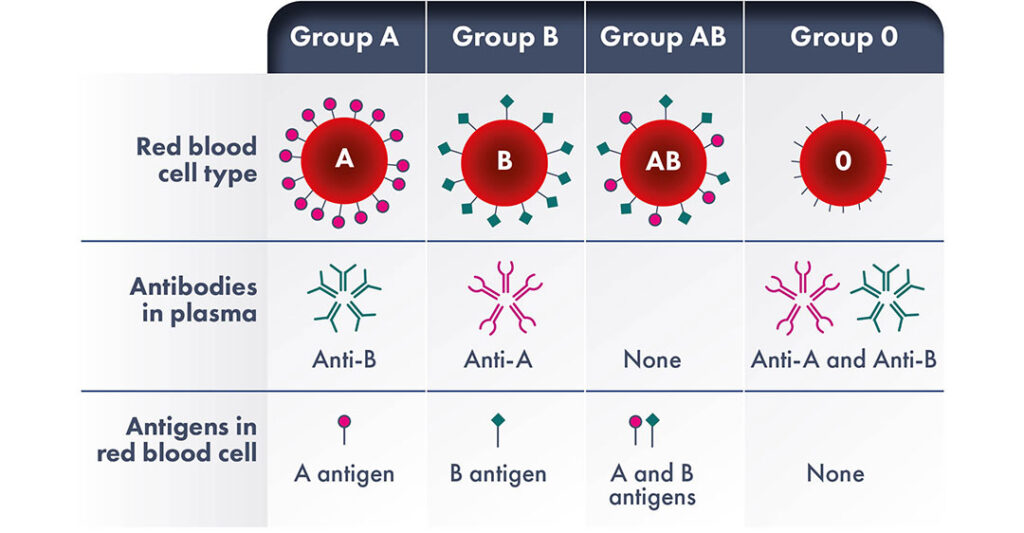
L’incompatibilité ABO
L’incompatibilité ABO est une incompatibilité congénitale entre les groupes sanguins maternel et fœtal, qui survient dans 15 à 20 % des grossesses. L’incompatibilité entre les antigènes sanguins ABO maternels et fœtaux est la principale cause de jaunisse néonatale et la forme la plus courante de maladie hémolytique du fœtus et du nouveau-né (MHFN). Toutefois, une MHFN clinique grave ne se développe que dans environ 1 % des cas de non-concordance des groupes sanguins.
La maladie généralement moins grave causée par l’incompatibilité ABO serait due à l’expression des antigènes A et B par le placenta et d’autres tissus, ce qui permet à ces antigènes de s’associer aux allo-anticorps maternels dans une certaine mesure. En outre, l’expression des antigènes des groupes sanguins A et B sur les globules rouges du fœtus n’est pas complètement développée, ce qui réduit les sites antigéniques à la surface des globules rouges du fœtus auxquels les anticorps peuvent se lier.
Il convient de rappeler que les personnes commencent naturellement à produire des anticorps A et/ou B contre des antigènes qu’elles ne possèdent pas vers l’âge de 3 à 6 mois. Par conséquent, la MHFN ABO peut survenir dès la première grossesse sans aucune exposition préalable à des antigènes étrangers. Contrairement à d’autres types de MHFN, il est observé presque exclusivement chez les mères du groupe sanguin O et est plus fréquent avec le groupe sanguin A du fœtus.
Les mères du groupe sanguin O ont des immunoglobulines naturelles de classe G (IgG) contre les groupes sanguins A ou B, qui sont capables de traverser le placenta. Pendant la grossesse, la formation de titres anti-A, anti-B et anti-A, B de la classe IgG peut augmenter fortement.
Les patients des groupes A et B développent également des anticorps respectifs contre les antigènes qu’ils ne possèdent pas, bien qu’ils ne soient normalement pas exposés au risque d’EHFRN, car ces anticorps sont presque toujours de classe IgM et ne peuvent donc pas provoquer de maladie fœtale ou néonatale car ils ne traversent pas le placenta.
Dans de rares cas, l’incompatibilité ABO a été signalée comme une cause d’anémie fœtale grave et de morbidité périnatale. Il existe une différence frappante, et toujours incomprise, dans l’incidence de l’EHFRN à médiation ABO entre les populations. L’incidence est d’environ 0,3-0,8 % dans la population caucasienne, contre 3-5 % dans les populations noires ou asiatiques, avec également une évolution clinique plus sévère.
L’allo-immunisation aux antigènes érythrocytaires du fœtus ou du nouveau-né
Le mécanisme le plus impliqué dans la MHFN est l’allo-immunisation due au développement d’anticorps maternels dirigés contre un antigène présent à la surface des globules rouges fœtaux lorsqu’ils pénètrent dans la circulation sanguine maternelle. La production d’anticorps maternels dirigés contre les antigènes des globules rouges fœtaux est déclenchée par des transfusions antérieures et des hémorragies fœto-maternelles (HFM).
Le taux d’allo-immunisation dans la population générale varie entre 2 et 7 %, avec une probabilité plus élevée chez les patients transfusés. Pendant la grossesse, le taux est estimé entre 0,4 % et 1,2 %.
Après une transfusion sanguine, 1 à 2 % des personnes développent des anticorps de groupe sanguin ; la plupart ont peu de conséquences, mais certains peuvent induire une forme sévère de MHFN.
L’allo-immunisation due à l’HFM est un mécanisme acquis à médiation immunitaire qui affecte généralement les grossesses ultérieures plutôt que la grossesse au cours de laquelle l’HFM s’est produite.
Il a été démontré que 75 % des femmes présentent une HFM pendant la grossesse ou au moment de l’accouchement. Chez environ 50 % de ces femmes, l’HFM ne dépasse pas 0,1 ml de sang fœtal. Moins de 1% des femmes ont plus de 5 ml, et moins de 0,25% ont plus de 30 ml de sang fœtal dans leur circulation. Certaines situations obstétricales augmentent le risque d’HFM, comme l’hémorragie antepartum, la toxémie gravidique, la version externe, la césarienne et le retrait manuel du placenta.
Antigènes et immunisation
Différents antigènes sont présents à la surface des globules rouges (GR). Certains de ces antigènes sont responsables du développement de la réponse immunitaire qui conduit à la MHFN, tandis que d’autres ne le sont pas. Le groupe de travail de la Société internationale de transfusion sanguine pour l’immunogénétique des globules rouges et la terminologie des groupes sanguins (ISBT WP) reconnaît 43 systèmes de groupes sanguins contenant 345 antigènes de globules rouges. Cependant, de nouveaux antigènes sont constamment découverts, de sorte que la connaissance des complexes antigène/anticorps possibles ne cesse d’augmenter. Les antigènes des globules rouges des différents systèmes de groupes sanguins sont soit des protéines, soit des glycolipides, et peuvent avoir différentes fonctions.
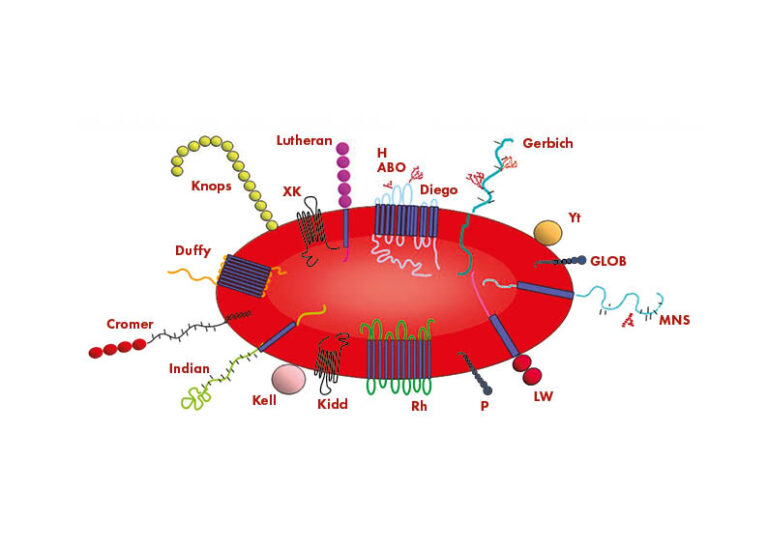
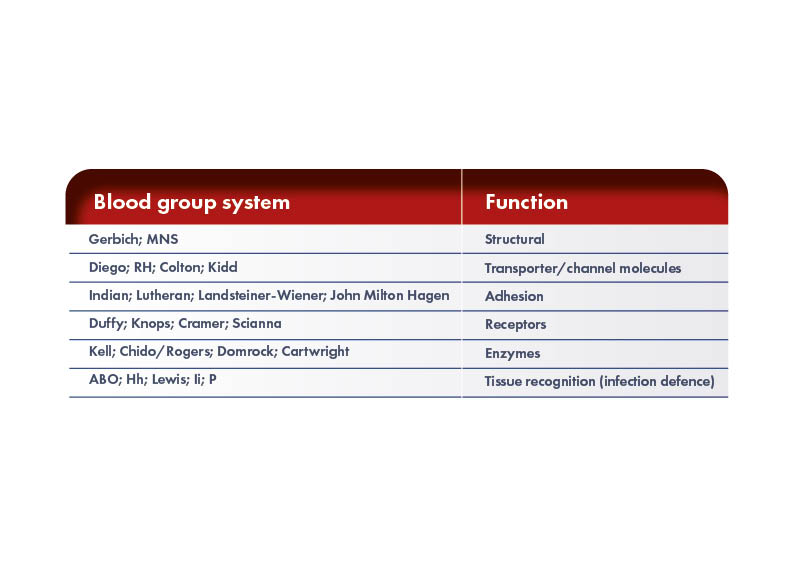
Le système Rh
Les différents antigènes de GR au sein des divers systèmes de groupes sanguins et entre eux ont un impact différent sur la production d’anticorps, mais seule une petite proportion de ces antigènes provoque des incompatibilités de GR cliniquement pertinentes. L’antigène de surface des globules rouges le plus souvent impliqué dans la forme sévère de l’EHFRN est le facteur rhésus, découvert dans les années 1940 chez les singes rhésus.
Le système de groupe sanguin Rh est le deuxième système de groupe sanguin le plus important sur le plan clinique après le système ABO. Ce système se compose de 55 antigènes de surface héréditaires, dont les principaux sont les antigènes D, C, c, E et e qui sont codés par deux gènes hautement homologues : RHD et RHCE.
L’antigène le plus immunogène est l’antigène D (RhD). Une personne est considérée comme Rh positif (RhD+) ou Rh négatif (RhD-) selon la présence ou l’absence de l’antigène RhD à la surface des globules rouges. Il n’a jamais été prouvé qu’il existait un antigène d. Les antigènes sont hérités en deux séries de trois, une de chaque parent. Les ensembles les plus courants sont CDe(R1), c(d)e(r) et cDE(R2).
Moins de 50 % des personnes Rh-positives sont homozygotes pour D (c’est-à-dire qu’elles ont hérité d’un ensemble d’antigènes contenant D de leurs deux parents). Si le partenaire Rh positif d’une femme Rh négatif est homozygote, tous ses enfants seront Rh positif. S’il est hétérozygote, le fœtus sera Rh négatif ou Rh positif avec la même probabilité. Seuls les fœtus Rh positif peuvent provoquer une immunisation Rh et la production d’anticorps anti-D chez les femmes RhD négatif détermine l’érythroblastose fœtale chez les fœtus RhD positif. L’antigène D est déjà présent à partir de la sixième/septième semaine de gestation, et 0,1 ml de globules rouges fœtaux D+ peut allo-immuniser une mère Rh négatif. La positivité du RhD varie en fonction de l’origine ethnique : elle est présente chez 85 % des Caucasiens, 95 % des Africains sub-sahariens et plus de 99,5 % des Asiatiques de l’Est.
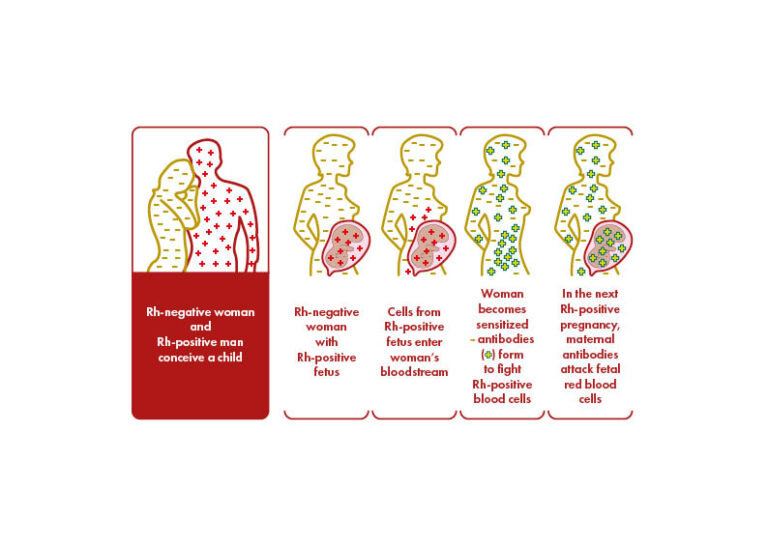
Quel antigène est responsable des cas les plus graves de MHFN ?
L’antigène RhD est le plus immunogène des antigènes du système Rh, et les anticorps anti-D sont associés au risque le plus élevé de mortalité et de morbidité fœtales. Les antigènes rhésus autres que RhD, notamment c, C, E et e, sont souvent impliqués et peuvent provoquer une hémolyse sévère. Les antigènes des systèmes de groupes sanguins Kell, Duffy, MNS et Kidd sont également à l’origine de formes graves de la maladie hémolytique du fœtus et du nouveau-né.
Il est important de comprendre les différentes incompatibilités des globules rouges et la production d’anticorps à l’origine de la MHFN pour prévoir, prévenir, surveiller et prendre en charge les grossesses et les nouveau-nés exposés aux effets de la maladie hémolytique du fœtus et du nouveau-né.
Pour prévenir la sensibilisation au Rh et l’anémie hémolytique qui s’ensuit chez le fœtus, une prophylaxie anti-Rh(D) est administrée aux femmes RhD négatives pendant et après la grossesse.
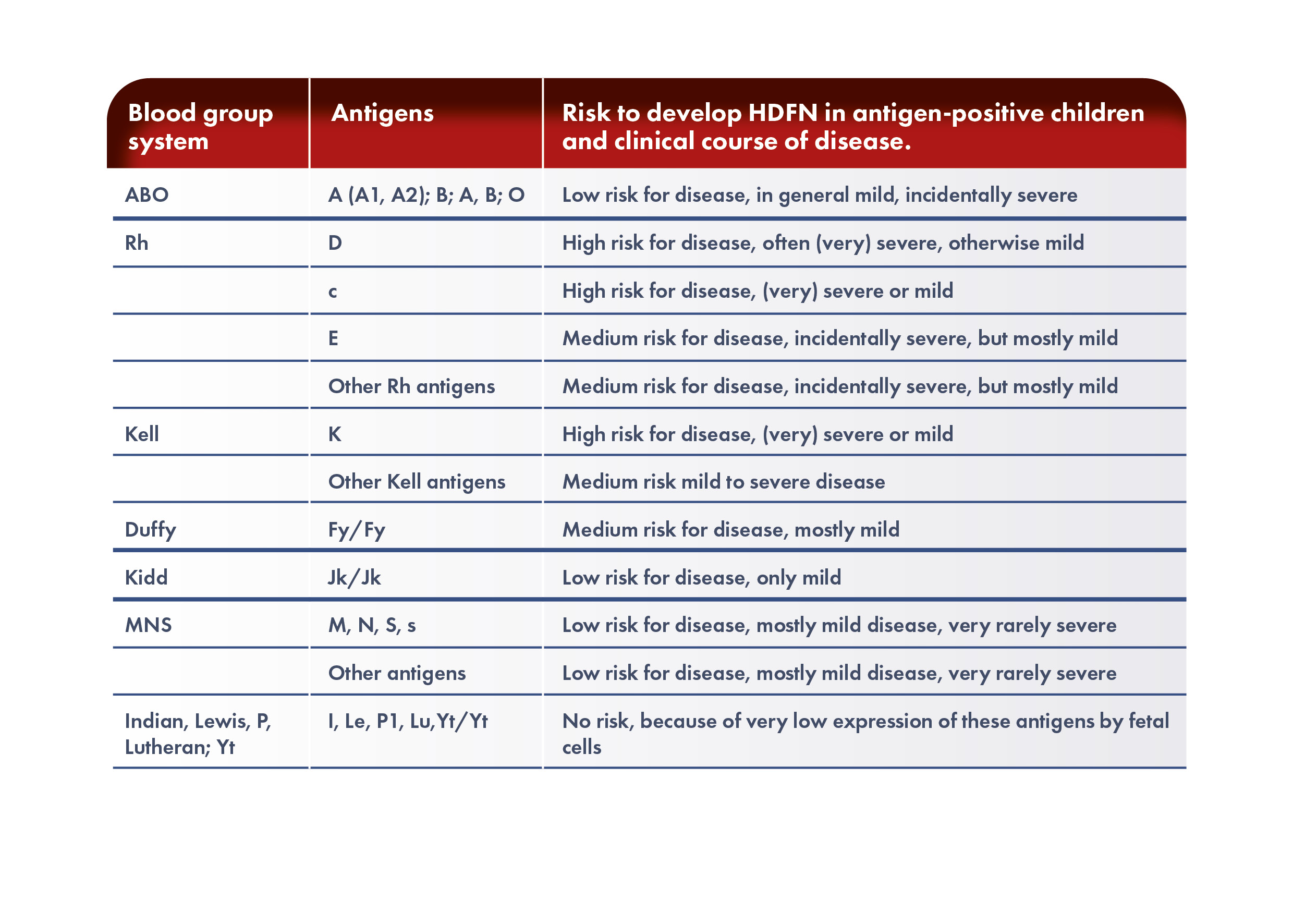
Quelle est la physiopathologie de la MHFN ?
La MHFN se produit lorsque le fœtus ou le nouveau-né hérite d’un antigène de globules rouges du père qui n’est pas présent dans les globules rouges de la mère. Cet antigène du non-soi déclenche la production d’anticorps spécifiques par la mère. Les anticorps IgG maternels traversent le placenta et passent dans la circulation sanguine du fœtus, se lient à l’antigène étranger et provoquent une hémolyse, voire une anémie. L’anémie fœtale induit une érythropoïèse compensatoire qui peut être insuffisante, entraînant une circulation hyperdynamique chez le fœtus, ce qui provoque une cardiomégalie et une insuffisance hépatique. L’insuffisance hépatique entraîne une diminution des taux de protéines et de la pression oncotique dans la circulation, tandis que l’insuffisance cardiaque provoque une augmentation de la pression veineuse, ce qui entraîne un œdème généralisé et une ascite, connus sous le nom d’anasarque fœtale, dont le taux de mortalité périnatale est élevé.
L’hémolyse des globules rouges du fœtus entraîne une augmentation des taux de bilirubine, qui traverse le placenta et est éliminée par la circulation maternelle pendant la grossesse. Après la naissance, le foie immature du nouveau-né ne peut pas conjuguer suffisamment l’excès de bilirubine, ce qui peut entraîner une hyperbilirubinémie sévère et des lésions irréversibles du système nerveux central, connues sous le nom d’ictère nucléaire. Cet état se caractérise par un dépôt de bilirubine dans les ganglions de la base et les noyaux du tronc cérébral, en corrélation avec une morbidité à long terme telle que la paralysie cérébrale athétosique, la déficience auditive et les handicaps psychomoteurs.
LE DIAGNOSTIC PRÉNATAL
La maladie hémolytique du nouveau-né est généralement diagnostiquée lors du dépistage prénatal de routine. Prédire le statut RhD fœtal par dépistage prénatal non invasif du gène RhD fœtal (RHD) peut guider l’utilisation ciblée de la prophylaxie anti-D prénatale.
Qu’est-ce que la MHFN pendant la grossesse ?
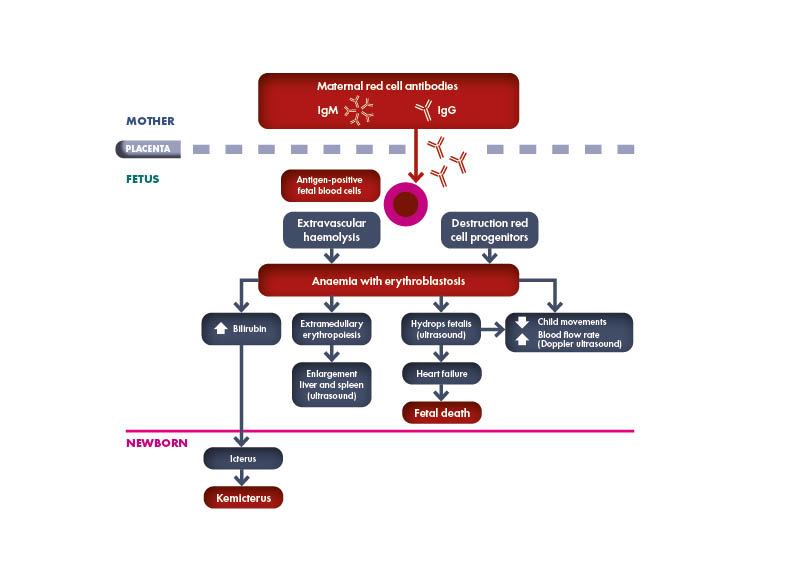
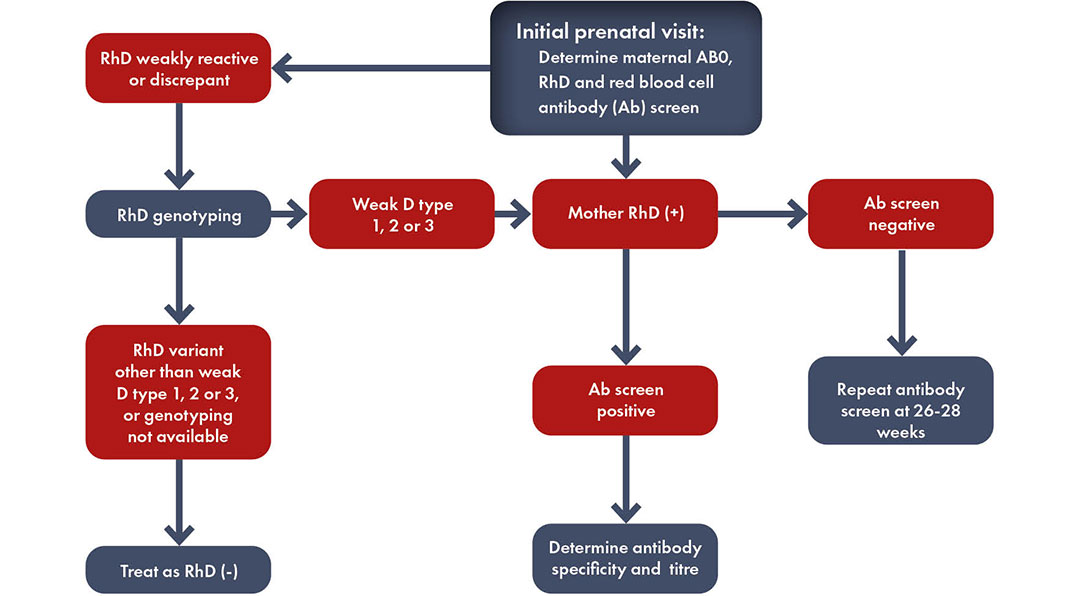
Toutes les femmes enceintes devraient subir un typage sanguin et un dépistage des anticorps pour identifier le statut Rh et la présence d’une immunisation qui présente un risque pour le fœtus en ce qui concerne la maladie hémolytique du fœtus et du nouveau-né (MHFN), également connue sous le nom d’érythroblastose fœtale.
Selon l’Académie américaine de pédiatrie (AAP), « si la mère n’a pas subi de typage sanguin prénatal ou si elle est Rh négatif, il est fortement recommandé d’effectuer un test d’anticorps direct (ou test de Coombs), de déterminer le groupe sanguin et le groupe Rh (D) dans le sang du bébé (cordon ombilical) ».
Le groupe sanguin et la détection d’anticorps anti-GR irréguliers doivent être vérifiés au cours de la 28e semaine de grossesse. Le statut Rh et ABO du père du fœtus d’une femme enceinte Rh négatif doit être déterminé. Si le père est hétérozygote, le risque de sensibilisation au Rh est réduit de moitié. Si le génotype ABO et Rh du père est connu, le risque d’immunisation Rh peut être estimé.
Il est important de refaire régulièrement le test de dépistage chez une femme enceinte Rhésus négatif dont le partenaire est Rhésus positif. Des tests supplémentaires doivent être effectués entre la 18e et la 20e semaine de grossesse, puis toutes les 4 semaines, sachant que la réponse immunitaire initiale se produit rarement avant la 20e semaine de gestation.

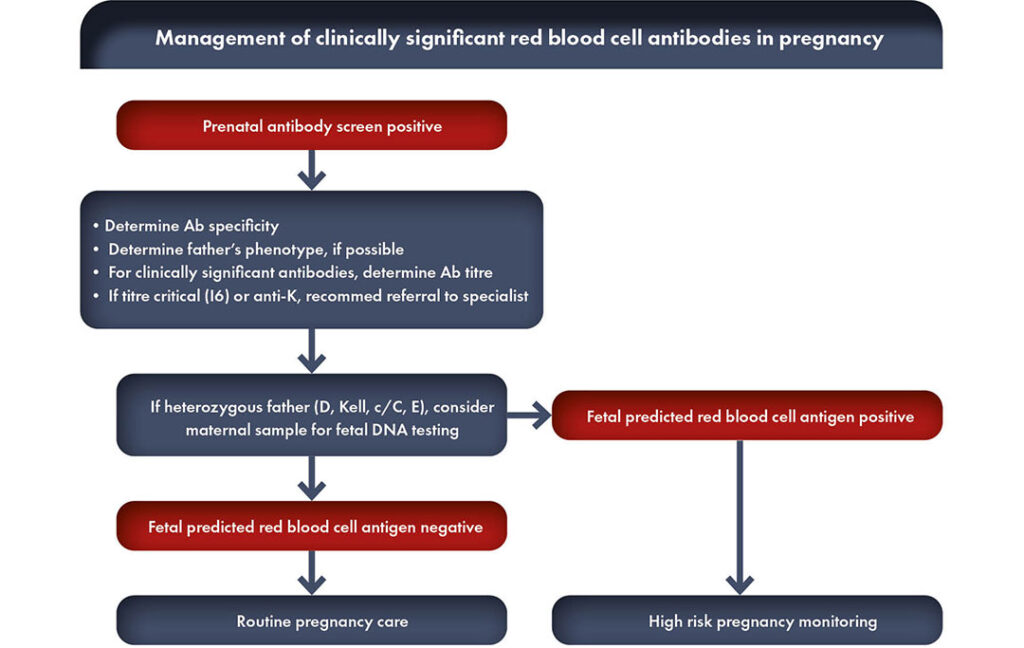
Quels sont les alloanticorps érythrocytaires cliniquement significatifs ?
Lorsque la présence ou le développement d’allo-anticorps érythrocytaires n’est pas détecté pendant la grossesse, les seules caractéristiques cliniques non spécifiques et imprévisibles de la MHFN pendant la grossesse sont une diminution des mouvements fœtaux ou une mort fœtale soudaine.
Lorsque la présence d’anticorps anti-Rh maternels est identifiée par le dépistage, la femme enceinte doit être surveillée par des tests de laboratoire répétés (titres d’anticorps, quantification des anticorps, cytotoxicité cellulaire dépendante des anticorps ou CCDA). Si ces tests sériques dépassent un certain seuil, des examens cliniques dans des centres spécialisés, tels que l’échographie Doppler, sont nécessaires pour la détection précoce d’une EHFRN sévère nécessitant une thérapie fœtale ou un accouchement avec traitement néonatal.
Ainsi, un programme de dépistage vise à identifier les grossesses pour lesquelles un traitement intra-utérin du fœtus est nécessaire et/ou le travail doit être déclenché pour réduire le risque de développer une maladie hémolytique sévère. En l’absence de programme de dépistage, le traitement peut être retardé.
Quels sont les tests de laboratoire nécessaires pour diagnostiquer la MHFN pendant la grossesse ?
Étant donné que le fœtus peut devenir gravement anémique à partir de 16 semaines de gestation, un typage sanguin fœtal non invasif avec de l’ADN fœtal acellulaire (cfDNA) provenant du plasma maternel devrait être effectué avant 14-15 semaines pour le dépistage des femmes RhD négatives non immunisées.
Étant donné que l’ADNcf ne représente qu’une fraction de l’ADN cellulaire total présent dans le plasma maternel, il est nécessaire de disposer d’une technologie d’extraction de l’ADN très efficace et d’une technologie de détection sensible, actuellement la PCR quantitative.
D’autres méthodes appliquées au typage RHD du fœtus comprennent l’extension d’une seule base suivie de la démonstration de produits spécifiques par GeneScan ou spectromètre de masse.
Récemment, une PCR numérique basée sur une puce pour le typage du groupe sanguin fœtal a été décrite. Cette méthode est appelée « droplet digital PCR » (ddPCR). Dans une ddPCR, chaque gouttelette contient une seule copie du gène maternel ou fœtal, de sorte que la présence d’une copie fœtale se traduira toujours par un signal positif fort qui peut être facilement distingué des gouttelettes contenant des copies de l’ADN maternel.
Certains laboratoires utilisent la confirmation de la présence d’ADN fœtal avec d’autres séquences d’ADN héritées par le père (par exemple SRY) ou un marqueur universel d’ADN fœtal (par exemple RASSF1a méthylé) pour fournir des résultats concluants en un seul test. On peut conclure que le génotypage fœtal non invasif peut être utilisé de manière fiable pour cibler le suivi clinique et de laboratoire des cas qui risquent de développer une forme grave de la maladie.
Niveau de gravité de la maladie hémolytique
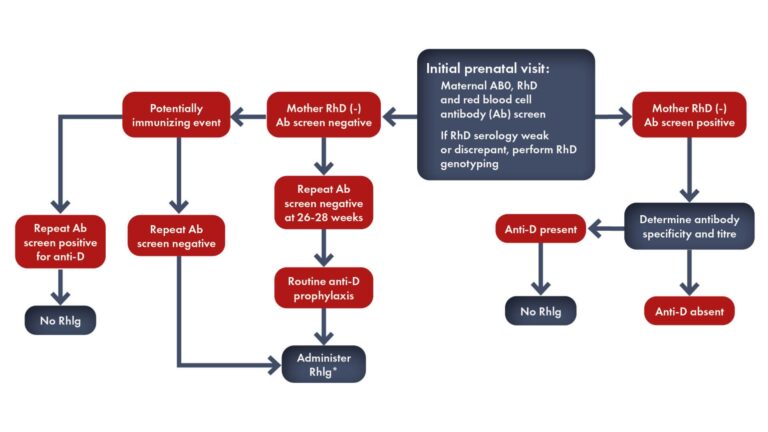
Chez les femmes immunisées Rhésus négatif, il est de la plus haute importance de déterminer le degré de gravité de l’érythroblastose (le cas échéant) chez le fœtus.
Six paramètres permettent d’évaluer le degré de gravité de la maladie hémolytique :
- l’histoire de la maladie
- titres d’anticorps maternels
- Tests fonctionnels à médiation cellulaire des anticorps maternels
- Mesures spectrophotométriques du liquide amniotique
- Évaluation par ultrasons
- Prélèvement direct de sang fœtal
- La définition de la gravité est la suivante :
L’expression « MHFN très grave » désigne les cas de décès intra-utérin et les cas traités par transfusion intra-utérine (IUTI) et/ou par exsanguino-transfusion (ET) après la naissance.
L' »MHFN sévère » comprend également les cas traités par des transfusions supplémentaires et les cas pour lesquels un déclenchement précoce du travail est nécessaire.
La « gravité légère » est définie comme les cas où le déclenchement précoce du travail n’est pas nécessaire et où le traitement par photothérapie est suffisant.
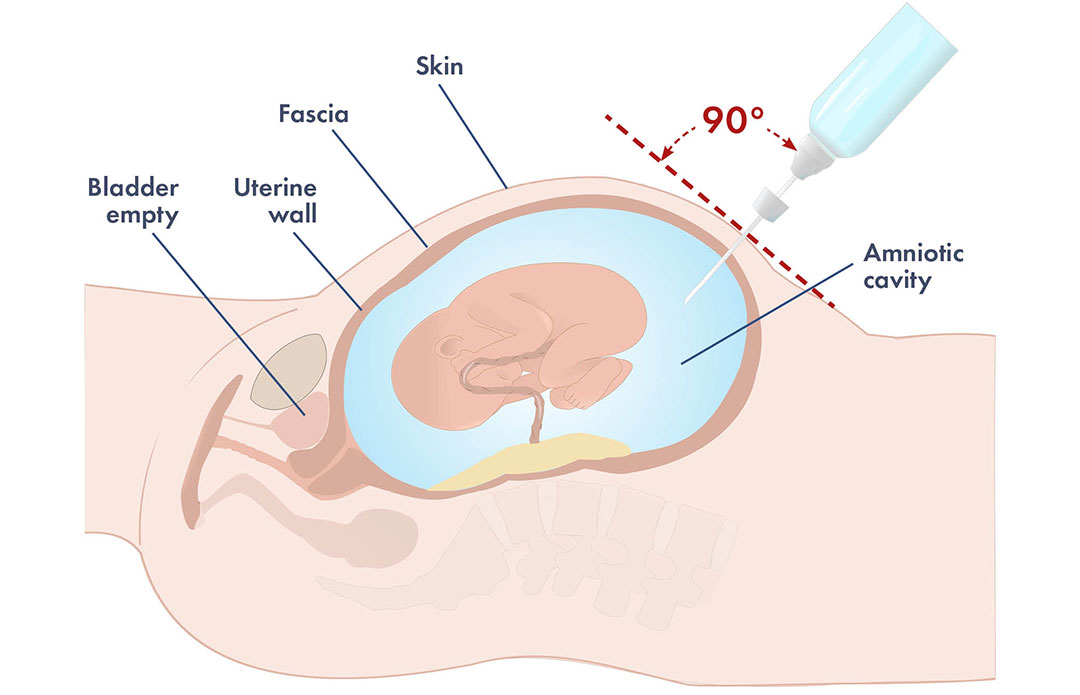
Les risques de l’amniocentèse et du déclenchement de l’accouchement avant terme
Il convient de noter qu’en raison du risque permanent d’hémorragie fœto-maternelle (HFM) et de l’augmentation consécutive des titres d’anticorps et de la gravité de l’hémolyse, l’amniocentèse ne doit être effectuée qu’après une localisation minutieuse du placenta par échographie. L’amniocentèse réalisée sans guidage échographique est associée à un risque de 10 à 11 % de HFM et à une gravité accrue de l’érythroblastose. Cependant, même si elle est guidée par échographie en tant que manœuvre invasive, l’amniocentèse peut entraîner une HFM. Par conséquent, elle ne doit être pratiquée que si les antécédents ou le titre d’anticorps indiquent que le fœtus risque de développer une anasarque et de mourir. Quel que soit le titre des anticorps, l’amniocentèse doit être pratiquée entre 18 et 19 semaines de gestation en cas d’antécédents de mortinatalité ou si le nouveau-né précédent a dû subir une ET après sa naissance. En l’absence de tels antécédents, l’amniocentèse ne doit être pratiquée que si le titre d’anticorps indique un risque persistant d’anasarque.
Seuls les fœtus qui deviendront hydropiques avant 34 semaines de gestation devraient subir des transfusions sanguines fœtales et seuls ces fœtus et ceux qui deviendront hydropiques entre 34 semaines de gestation et le terme devraient être exposés aux risques d’un travail prématuré induit. Le risque de décès lié à un traumatisme transfusionnel fœtal (intrapéritonéal) est de 10 à 15 % entre 22 et 23 semaines de grossesse et tombe à 3 à 5 % après 28 semaines. Chez le prématuré atteint d’érythroblastose sévère, le risque de décès est encore significatif aujourd’hui à 32 semaines de gestation.
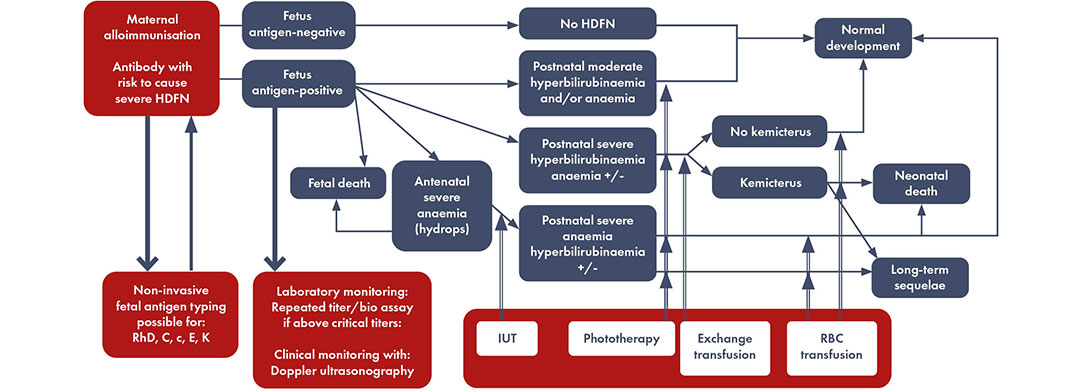
Modèle d’allo-immunisation maternelle conduisant à la maladie hémolytique du fœtus et du nouveau-né, et tests de laboratoire et tests cliniques éventuels permettant de distinguer les cas à haut risque. Modifié par Haas M et al, 2015.
*Si le typage non invasif de l’antigène fœtal n’est pas disponible, les grossesses doivent être suivies comme si le fœtus était positif à l’antigène lorsque le père biologique est homozygote ou hétérozygote positif pour l’antigène en question. Les grossesses peuvent être suivies comme si le fœtus était négatif lorsque le résultat du typage non invasif de l’antigène fœtal est négatif ou lorsque l’on sait avec certitude que le père biologique est homozygote négatif pour l’antigène en question.
ÉVALUATION POSTNATALE
De nombreuses femmes n'ont que peu ou pas de sang fœtal détectable dans leur circulation pendant la grossesse, et seulement de petits volumes (<0,1 ml) qui peuvent augmenter légèrement au cours du troisième trimestre. Après l'accouchement, l'incidence et le volume de l'hémorragie fœto-maternelle (HFM) sont généralement plus élevés, ce qui explique pourquoi davantage de femmes sont immunisées par le vaccin D après l'accouchement que pendant la grossesse.
Il est crucial que toutes les femmes RhD négatif soient dépistées après l’accouchement pour l’HFM. En cas de résultat positif, le volume de l’hémorragie fœto-maternelle doit être quantifié. Des volumes élevés d’HFM peuvent entraîner la mort du fœtus ou une anémie néonatale sévère nécessitant une transfusion rapide.
Les femmes RhD négatif doivent recevoir une dose adéquate d'immunoglobuline anti-D (Ig anti-D) pour détruire tous les globules rouges (GR) fœtaux dans leur circulation, afin de prévenir l’immunisation RhD qui pose des risques de maladie hémolytique du fœtus et du nouveau-né (MHFN) dans les futures grossesses RhD positif. Cette prophylaxie anti-Rh(D) est essentielle pour prévenir la sensibilisation au Rh.
Quels sont les résultats de l’évaluation de la maladie hémolytique fœtale ou néonatale ?
La maladie hémolytique du fœtus et du nouveau-né (MHFN) doit être envisagée dans le diagnostic différentiel des nouveau-nés présentant une jaunisse/hyperbilirubinémie et certainement en cas d’anémie néonatale. L’anémie hémolytique chez le fœtus peut entraîner une érythroblastose fœtale grave.
À la naissance, la connexion à la circulation maternelle est rompue et, en raison du développement immature de la voie métabolique permettant de dégrader la bilirubine dans le foie néonatal, le risque d’hyperbilirubinémie néonatale augmente considérablement. La prise en charge de l’hyperbilirubinémie est critique pendant la période néonatale en raison du risque d’encéphalopathie induite par la bilirubine.
Pour les nouveau-nés présentant une MHFN avérée, une surveillance étroite des taux de bilirubine et d’hémoglobine est obligatoire pour déterminer si une transfusion d’échange néonatale est nécessaire pour éliminer la bilirubine et les anticorps de la mère, et/ou si des transfusions sont nécessaires pour renforcer la capacité de transport de l’oxygène vers les tissus. Les nourrissons doivent être surveillés attentivement pour déceler les signes cliniques d’une anémie en cours, qui se manifeste le plus souvent par une mauvaise alimentation, l’activité la plus aérobique pour les nouveau-nés. On peut également constater une augmentation du sommeil à mesure que l’anémie s’aggrave.
En cas d’anémie en cours, la production de réticulocytes de la moelle osseuse fœtale peut diminuer et d’autres lignées cellulaires, telles que les neutrophiles, peuvent être affectées. Une surveillance hebdomadaire des réticulocytes et de l’hématocrite permettra d’orienter la prise de décision au sujet de la transfusion et de rassurer lorsque la moelle se rétablit.
BANQUE
C’est en 1968 que l’immunoglobuline anti-Rh(D) a été approuvée pour prévenir l’apparition de la sensibilisation à l’antigène du groupe sanguin Rh(D) après l’accouchement chez les femmes Rh négatif.
Plus tard, la prophylaxie anti-Rh(D) a été étendue aux femmes Rh négatif enceintes, aux cas de fausse couche, de grossesse extra-utérine, d’amniocentèse, de saignement ou de traumatisme abdominal pendant la grossesse, et/ou à la version par manœuvre externe en cas de présentation par le siège.
Même si cette approche est très efficace pour prévenir la maladie hémolytique du nouveau-né, des données récentes ont montré que, dans environ 50 % des cas concernés dans le monde entier, l’immunoglobuline anti-Rh(D) n’est pas administrée.
L’insuffisance de l’offre, les raisons financières, le manque d’informations, le manque d’accès au produit immunisant et l’utilisation de produits dont l’efficacité thérapeutique n’a pas été testée sont les principales raisons de cette couverture préventive insatisfaisante. Il faut souligner que la maladie hémolytique néonatale est toujours la cause de plus de 160 000 décès périnataux et de 100 000 cas de handicap chaque année. Ces chiffres inquiétants ne représentent qu’une baisse de 50 % par rapport à l’époque précédant l’administration d’immunoglobuline, une situation qui, compte tenu de l’importance d’une maladie évitable, devrait être considérée comme inacceptable.
La Fédération internationale de gynécologie et d’obstétrique (FIGO) et la Confédération internationale des sages-femmes (IMC) ont publié en 2021 un document d’orientation commun sur la prévention de la maladie hémolytique néonatale par l’immunoprophylaxie, qui sera brièvement résumé dans cette partie.
La FIGO et l’IMC
La Fédération internationale de gynécologie et d’obstétrique (FIGO) et la Confédération internationale des sages-femmes (IMC) ont publié en 2021 un document d’orientation commun sur la prévention de la maladie hémolytique du nouveau-né par l’immunoprophylaxie, qui sera brièvement résumé dans cette partie.
Groupe sanguin et typage Rh(D)
La connaissance préalable du statut Rh de la mère est obligatoire pour prévenir la sensibilisation au Rh. Le typage Rh(D) doit, de préférence, être effectué au cours du premier trimestre de la grossesse, les indications pour l’immunoprophylaxie anti-Rh(D) pouvant apparaître tôt pendant la grossesse.
L’administration post-partum d’immunoglobuline anti-Rh(D)
La sensibilisation au Rh(D) se produit dans 16 % des grossesses des femmes Rh(D) négatif et l’administration d’immunoglobuline Rh(D) réduit ce risque à 1,5 %. Cette intervention devrait donc représenter la priorité majeure dans les pays/régions où la prophylaxie est actuellement inadéquate ou inexistante.
Une dose de 1500 UI (ou, de manière équivalente, 300 μg) d’anti-Rh(D) doit être administrée par voie intramusculaire dans les 72 heures qui suivent l’accouchement chez les femmes Rh négatif qui donnent naissance à un enfant Rh positif.
L’administration d’immunoglobuline anti-Rh(D) pendant la grossesse
Le travail joue un rôle crucial dans de nombreux cas de sensibilisation au Rh(D). L’immunoprophylaxie pendant la grossesse est donc cruciale. L’administration prénatale d’immunoglobuline anti-Rh(D) peut être effectuée par voie intramusculaire ou intraveineuse. Elle peut être administrée une fois (1500 UI) entre la 28e et la 34e semaine de grossesse, ou deux fois à la 28e et entre la 32e et 34e semaine de grossesse (625 UI ou 1500 UI aux deux âges gestationnels).
Fausse couche
L’immunoprophylaxie devrait être effectuée seulement sur les femmes ayant subi une fausse couche spontanée ou médicamenteuse après 10 semaines de grossesse. Dans le cas d’un traitement chirurgical de la fausse couche, il est suggéré d’envisager la prophylaxie également avant 10 semaines de grossesse.
Grossesse extra-utérine
L’administration d’immunoglobuline anti-Rh(D) est fortement conseillée en cas de grossesse extra-utérine, car il a été démontré qu’une grossesse tubaire rompue est associée à une incidence de 24 % d’allo-immunisation contre Rh(D).
Prélèvement de villosités choriales (PVC) ou amniocentèse
Dans la plupart des pays, mais pas dans tous, il est suggéré d’administrer de l’immunoglobuline anti-Rh(D) aux femmes enceintes Rh(D) négatif après un PVC ou une amniocentèse.
Saignement et traumatisme abdominal pendant la grossesse
La prophylaxie avec administration d’immunoglobuline anti-Rh(D) est conseillée en cas de traumatisme abdominal, car cet état peut provoquer une transfusion fœtale-maternelle et, par conséquent, une augmentation du risque d’allo-immunisation Rh(D). La dose d’immunoglobuline anti-Rh(D) la plus couramment administrée est de 1500 UI.
Mort in utero
Étant donné que la mort in utero d’un fœtus peut être le résultat d’une hémorragie fœtomaternelle (HFM) évidente, l’importance du saignement doit être déterminée par un test approprié, tel que le test de Kleihauer-Betke, afin d’établir la dose correcte d’immunoglobuline anti-D nécessaire.
Version Céphalique Externe en cas de Présentation par le Siège
La procédure de version céphalique externe présente un risque de FMH allant de 2 à 6%. Il est donc conseillé d’effectuer une immunoprophylaxie par anti-Rh(D) à la 32e semaine de grossesse.
Qu’est-ce que le test d’ADN fœtal non invasif RhD ?
Le statut Rh(D) du fœtus peut être déterminé par un test prénatal non invasif de l’ADN acellulaire effectué au cours du premier trimestre de la grossesse. Les décideurs sanitaires devraient inclure ce test non invasif dans les options futures de lutte contre la maladie hémolytique néonatale.
De combien de doses d’anti-D ai-je besoin ?
La dose d’immunoglobuline anti-Rh(D) à administrer à une femme enceinte Rh négatif varie en fonction des différentes conditions.
Priorité élevée
Déterminer le facteur Rh de la mère, de préférence en début de grossesse.
Pour les femmes Rh(D) négatif, déterminer le facteur Rh du nouveau-né à partir du sang du cordon ombilical. Administrer l’immunoglobuline anti-Rh(D) dans les 72 heures suivant l’accouchement aux femmes ayant un nouveau-né Rh(D) positif, à moins qu’elles ne soient déjà sensibilisées.
Utiliser une dose de 500 UI (100 µg) d’immunoglobuline anti-Rh(D) ; si le prix est abordable et l’offre suffisante, 1500 UI (300 µg) peuvent être administrées, comme c’est souvent le cas dans les pays à revenu élevé. La voie intramusculaire est aussi efficace que la voie intraveineuse.
Priorité moyenne
Prophylaxie anti-Rh(D) de routine pendant la grossesse : 1500 UI (300 µg) entre la 28e et la 34e semaine. Prophylaxie par immunoglobuline anti-Rh(D) (500 UI ; 100 µg) après une IVG chirurgicale ou une grossesse extra-utérine (tous les âges gestationnels), ou après un avortement spontané (fausse couche) ou médicamenteux après 10 semaines.
Prophylaxie anti-Rh(D) après un saignement, un traumatisme abdominal pendant la grossesse et/ou une mort fœtale (500 ou 1500 UI ; 100 ou 300 µg) au cours du deuxième ou troisième trimestre. Le test de Kleihauer-Betke peut être utilisé pour estimer la dose optimale.
Priorité basse
Prophylaxie anti-Rh(D) après l’amniocentèse, le prélèvement de villosités choriales ou une version par manœuvre externe (500 UI ; 100 µg).

